II. ACDS, BASES VÀ CÁC HỆ ĐỆM
– Nhiều hợp chất hóa sinh, từ các phân tử nhỏ đến các polymers lớn đều có khả năng giải phóng hoặc nhận các proton ở pH sinh lí, kết quả là chúng có thể tích điện.
– Hầu hết các phản ứng hóa sinh xảy ra trong các dung môi dạng lỏng.
– pH của một dung môi là bằng âm logarith cơ số 10 của nồng độ ion hydro của chính dung dịch [H+].
– Các acid là những chất cho proton và base là những chất nhận proton.
– Phương trình Henderson-Hasselbalch mô tả mối liên hệ giữa pH, pK (bằng –log của hằng số phân li), nồng độ của một acid và base liên hợp của nó.
– Các hệ đệm bao gồm các dung dịch chứa cặp acid-base liên hợp, giúp hạn chế sự thay đổi trong pH khi H+ hoặc OH- được thêm vào.
– Các acids được ăn vào hay được sản xuất bởi cơ thể được đệm bởi bicarbonate và các protein, một phần từ hemoglobin. Những hệ đệm này giúp duy trì pH của cơ thể trong giới hạn phù hợp với sự sống.
A. Nước:
1. Nước là dung môi của sự sống. Nó phân li:

Với một hằng số cân bằng:

2. Bởi vì mức độ phân li thì không đáng kể, nên H2O vẫn hằng định ở một nồng độ mol là 55,5 M và tích số ion của H2O là:

3. pH của dung dịch là âm logarith cơ số 10 của nồng độ ion hydrogen trong dung dịch [H+]:

Đối với nước tinh khiết,

Vì thế, pH của nước tinh khiết là 7.
B. Acids và bases:
Các acid là những hợp chất cho proton và bases là những hợp chất nhận proton.
1. Sự phân li các acid:
a. Các acid mạnh, như hydrochloric acid (HCl), thì phân lí hoàn toàn.
b. Các acid yếu, như acetic acid, phân li chỉ một phần:

Trong đó HA là acid và A- là base liên hợp của nó.
c. Hằng số phân li đối với acid yếu là:

2. Phương trình Handerson-Hasselbalch xuất phát từ phương trình đối với hằng số phân li:

Trong đó, pK là âm logarith cơ số 10 của K, hằng số phân li.
3. Các acid chính được tạo ra bởi cơ thể bao gồm phosphoric acid, sulfuric acid, lactic acid và các thể ketones, acetoacetic acid, beta-hydroxybutyric acid. CO2 cũng được tạo ra, chúng kết hợp với nước để hình thành nên carbonic acid trong một phản ứng xúc tác bởi carbonic anhydrase:
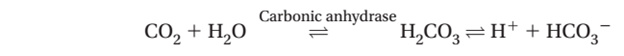
C. Các hệ đệm:
1. Các hệ đệm bao gồm các dung dịch chứa các cặp acid-base liên hợp, như acetic acid và acetate.
a. Ở giá trị pH dung dịch gần với pK của nó, thì một hệ đệm duy trì pH của dung dịch, chống lại sự thay đổi do sự thêm vào acid hay base. Đối với một acid yếu, thì pK thường được chỉ rõ là pKa.
b. Ở gía trị pH dung dịch bằng pKa, thì [A-] và [HA] bằng nhau và hệ đệm có chức năng tối đa.
2. Cơ chế đệm trong cơ thể:
a. Khoảng pH bình thường của máu động mạch là 7,37 đến 7,43.
b. Các hệ đệm chính của máu là bicarbonate (HCO3-/H2CO3) và hemoglobin (Hb/HHb).
c. Những hệ đệm này kết hợp với các cơ chế ở thận để bài tiết proton và các cơ chế ở phổi để thở ra khí CO2 để duy trì pH trong giới hạn bình thường.
LIÊN QUAN LÂM SÀNG
Rối loạn cân bằng acid-base xảy ra dưới nhiều tình trạng khác nhau. Giảm thông khí dẫn đến sự giữ lại CO2 tại phổi, điều này có thể dẫn đến nhiễm toan hô hấp. Tăng thông khí có thể dẫn đến nhiễm kiềm hô hấp. Toan chuyển hóa có thể do sự tích tụ các acid chuyển hóa (lactic acid hoặc các thể ketones, beta-hydroxybutyric acid và acetoacetic acid), hoặc tiêu hóa các acids hay các hợp chất chuyển hóa thành acids (như: methanol, ethylene glycol). Nhiễm kiềm chuyển hóa do sự tăng lên của HCO3-, dẫn đến tăng pH. Rối loạn cân bằng acid-base dẫn đến các đáp ứng bù giúp phục hồi pH bình thường. Ví dụ, một nhiễm toan chuyển hóa có thể dẫn đến tăng thông khi và giải phóng khí CO2, thành phần có khuynh hướng làm hạ pH. Trong suốt nhiễm toan chuyển hóa, thì thận bài tiết NH4+, chứa H+ được đệm bởi amonia:

Suy yếu cơ thắt dạ dày – thực quản có thể dẫn đến bệnh trào ngược, trong đó thành phần acid của dạ dày (HCl) đi lên thực quản. Kết quả của rối loạn này (sự tổn thương thực quản do trào ngược acid lên thực quản) có thể được điều trị một phần bởi sử dụng các thuốc ức chế H+/K+ ATPase vận chuyển proton trong dạ dày của tế bào thành, thành phần mà giúp bơm các protons vào trong lòng dạ dày (nhờ sự trao đổi với K+ bên ngoài tế bào) chống lại sự chênh lệch nồng độ do sử dụng năng lượng của ATP. Công dụng của những thuốc này làm tăng pH của thành phần trong dạ dày, làm giảm nhẹ sự tổn thương và cho phép mô lành.



